
LA CORTEZA ATÓMICA. MECÁNICA CUÁNTICA

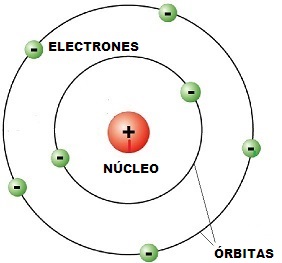
El modelo de Rutherford sobre la envoltura electrónica estaba en contradicción con la electrodinámica clásica, para la cual una carga eléctrica acelerada (y un electro girando alrededor del núcleo sufre una aceleración centrípeta) emite energía de forma continua. Según esto, el electrón debería perder rápidamente su energía y caer sobre el núcleo.
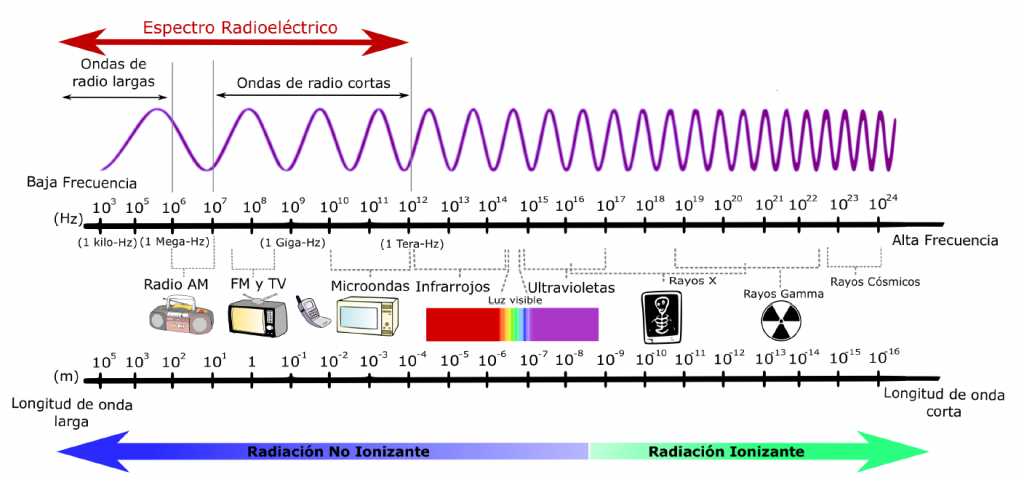
Espectros
Cuando ponemos de manifiesto un conjunto de radiaciones electromagnéticas, obtenemos su espectro. Cuando la luz blanca atraviesa un prisma y se descompone en los colores del arco iris, produce un espectro continuo en el cual las radiaciones componentes se encuentran ordenadas según su frecuencia. Otros espectros son discontinuos y contienen únicamente ciertas radiaciones que, en el caso de los espectros visibles, aparecen como rayas.
El espectro emitido por os átomos de un determinado elemento químico es discontinuo y está formado por un conjunto de rayas específicas de cada elemento. Una raya del espectro tiene una frecuencia fija, lo cual indica que los átomos emiten energía solo de forma discreta.
El átomo de Bohr
Para interpretar el espectro de hidrógeno, el átomo mas sencillo, Niels Bohr estableció en 1913 unos postulados según los cuales un electrón solo puede moverse alrededor del núcleo en ciertas orbitas permitida, en las que tienen una energía fija y determinada por lo tanto, mientras se mantenga en ellas, no emite energía. Cada nivel energético viene caracterizado mediante el llamado número cuántico principal, n, que es un numero entero (1, 2, 3…). Un electrón absorbe o emite energía en forma de un fotón al saltar de una órbita a otra más externa o más interna, respectivamente.
Con posterioridad se ha ido ajustando este modelo, al que se han añadido sucesivos subniveles energéticos.
¿Qué forma tienen las órbitas? ¿Son fijas o varían con el tiempo? Nuestra versión del mundo macroscópico influye en la idea que nos formamos de los fenómenos atómicos, pero parece que estos se resisten a ser interpretados con imágenes que nos sean familiares.
El movimiento de los cuerpos ha sido descrito y analizado en los apartados anteriores a través del formalismo llamado mecánica clásica. Su aplicamos las mismas leyes a las partículas elementales, los resultados obtenidos distan mucho de describir adecuadamente los fenómenos que se observan. Un electrón no puede ser considerado como una partícula que gira alrededor del núcleo.
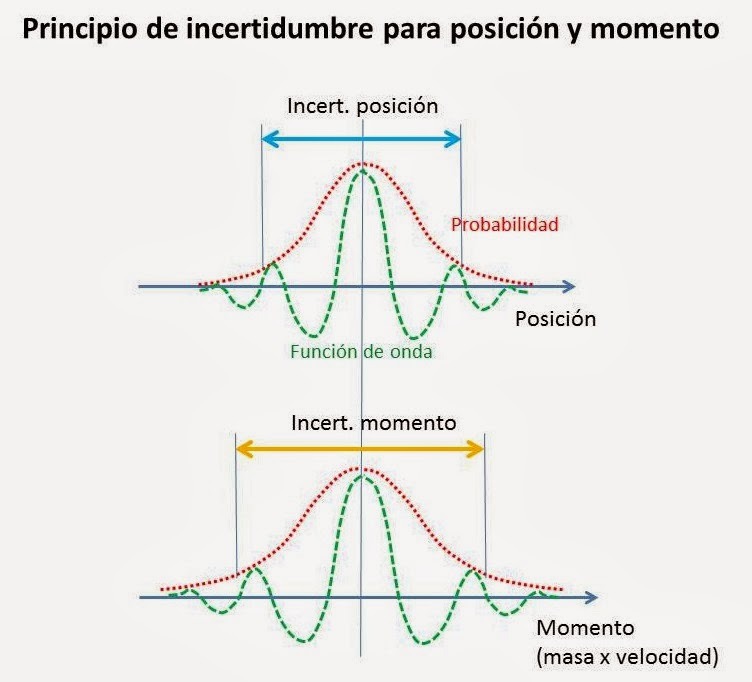
Principio de incertidumbre
Para describir el comportamiento de una partícula, debemos considerar su onda asociada. El propio proceso de medición de sus características corpusculares conlleva a la modificación significativa e imprevista de la magnitud medida. Este comportamiento aparentemente extraño se explicita en el principio de indeterminación de Heisenberg, según el cual, si queremos conocer con precisión la posición de una partícula en el espacio, ello será a expensas de una imprecisión en el cálculo de su velocidad (o su cantidad de movimiento). Lo mismo cabe decir de otros diversos pares de magnitudes como tiempo y energía.
Como consecuencia, la trayectoria de una partícula es un concepto que no puede ser definido de manera precisa y, por lo tanto, no es posible adjudicarle el significado que tiene para cuerpos de dimensiones mayores. Queda, así mismo, muy reducido el uso de conceptos como velocidad, aceleración y fuerza.
Mecánica cuántica
Para describir el comportamiento de un electrón alrededor del núcleo se ha elaborado un cuerpo teórico que, en esquema, se reduce a:
- El electrón viene representado por una onda estacionaria, confinada en una pequeña región del espacio alrededor del núcleo, cuya amplitud es variable para los diversos puntos de dicha zona, y sus valores se especifican en una función de onda.
- La probabilidad de encontrar una partícula en un punto está relacionada con el valor de la función de onda en él.
No podemos hablar de la órbita descrita por el electrón, sino que nos referimos a un orbital: la zona centrada en el núcleo, en la que es máxima la probabilidad de encontrar un electrón con una energía determinada.
Un orbital corresponde a un estado estacionario de energía del electrón. Su número cuántico principal determina su energía y su tamaño relativo.
Para identificar un orbital son necesarios otros números cuánticos. La cuantización del momento angular, que determina su forma, se resume en el numero cuántico secundario l, cuyos valores enteros oscilan entre 0 y n-l.
Se acostumbra a designar los calores de 1 (0, 1, 2, 3,…) con letras (s, p, d, f, g, etc.).
La orientación espacial del orbital viene consignada en m, el número cuántico magnético; s (spin) es el número cuántico que da cuenta del momento cinético intrínseco del electrón su rotación sobre sí mismo, y puede tener dos valores para electrones en un mismo orbital.
El principio de exclusión, enunciado en 1925 por Wolfgang Pauli, establece que dos electrones de un átomo no pueden tener los mismos cuatro números cuánticos, lo cual limita a dos electrones que caben en un mismo orbital.
Podemos pues, describir el estado dinámico de un electrón alrededor del núcleo especificando sus cuatro números cuánticos n, l, m y s.
¡Si te gustó el artículo no dudes en dejar un comentario aquí abajo!
Si quieres conocer otros artículos parecidos a LA CORTEZA ATÓMICA. MECÁNICA CUÁNTICA puedes visitar la categoría Fisica.





Deja un comentario