Enlaces metálicos y de hidrógeno. Fuerzas intermoleculares
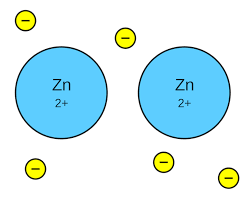
Enlace metálico
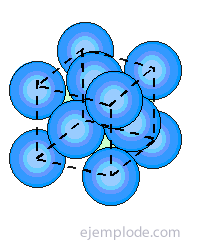
Los modelos del enlace iónico y covalente no explicaban las propiedades de los metales: resistencia mecánica, conducción de la electricidad, etc. Por ello fue preciso idear un nuevo modelo coherente con el comportamiento de estos elementos. Fue Hendrik Antoon Lorentz (1853-1928), físico holandés, quien elaboró una teoría al respecto, que más tarde justificaría el físico alemán Arnold Sommerfeld (1868-1951). Los átomos metálicos tienden a ceder sus electrones de la capa de valencia para convertirse en iones positios, más estables desde un punto de vista energético. Para ello, se forman enlaces covalentes resonantes entre átomos próximos. El resultado es la formación de iones metálicos positivos que se orientan formando una estructura cristalina, inmersa en una nube de electrones o «gas electrónico» que mantiene la neutralidad del conjunto. Los electrones deslocalizados justifican la conducción de la corriente eléctrica.
Propiedades generales de los metales
- 1. Tienen brillo metálico.
- 2. Son buenos conductores del calor y la electricidad debido a que los electrones de valencia se encuentran deslocalizados.
- 3. Tienen, en general, elevados puntos de fusión y de ebullición.
- 4. Poseen, generalmente, gran resistencia mecánica y son maleables y dúctiles.
Enlace de hidrógeno
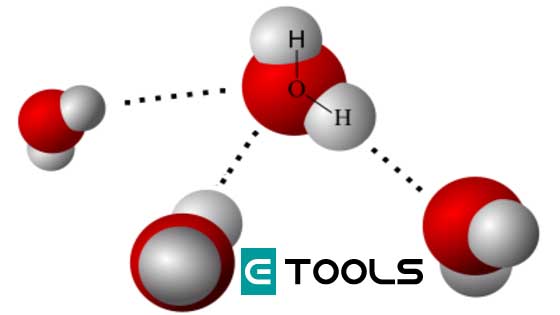
El enlace no sólo se produce entre átomos, sino que también se realiza, aunque más débilmente, entre moléculas. Un ejemplo de ello lo tenemos en el enlace de hidrógeno o de puente de hidrógeno.
Cuando este elemento se encuentra unido covalentemente a un átomo electronegativo se produce una polaridad en el enlace que le confiere un porcentaje de carácter iónico. El hidrógeno queda con una densidad de carga positiva, y es atraído por un par de electrones no compartidos, de un átomo electronegativo, con lo que se produce el enlace. Este último átomo debe tener un volumen pequeño para que su densidad de carga sea grande y pueda ejercer la atracción electrostática requerida por un átomo de hidrógeno. Es el caso del flúor, el oxígeno y el nitrógeno. El cloro, por ejemplo, debido a su gran volumen, nunca podrá participar en este tipo de enlace.
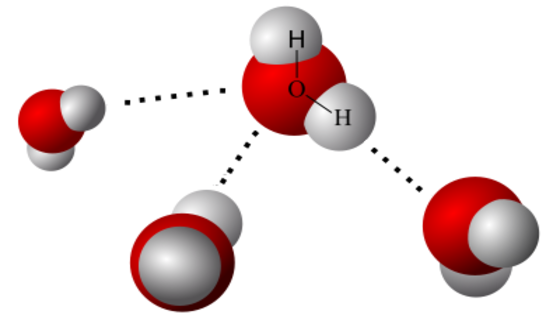
Propiedades generales de los enlaces cíe hidrógeno
- 1. Los enlaces de hidrógeno se encuentran en gases como el fluoruro de hidrógeno, líquidos como el agua y sólidos como el hielo.
- 2. Comparados con otras moléculas covalentes que no tienen este enlace adicional, tienen los puntos de fusión y de ebullición anormalmente elevados. Así, el agua (H20) es líquida a temperatura y presión ordinarias, y el sulfuro de hidrógeno (H2S), que por tener grande el átomo de azufre no forma puentes de hidrógeno, es gaseoso en las mismas condiciones.
Fuerzas intermoleculares
Acabamos de estudiar un tipo de fuerza intermolecular como es la relativa al enlace de puente de hidrógeno. En el artículo de enlace covalente hemos visto la polaridad de algunas moléculas: no es de extrañar que los polos de signos opuestos se atraigan entre sí originando una fuerza intermolecular llamada dipolo-dipolo. Otro tipo de fuerzas intermoleculares son las de London. Se originan cuando, momentáneamente, se produce un dipolo en un átomo que induce otro dipolo en un átomo contiguo, y así sucesivamente. Estos tres tipos de fuerzas intermoleculares de corto alcance reciben, en conjunto, el nombre de fuerzas de Van der Waals.
¡Si te gustó el artículo no dudes en dejar tu comentario aquí abajo!
Si quieres conocer otros artículos parecidos a Enlaces metálicos y de hidrógeno. Fuerzas intermoleculares puedes visitar la categoría Quimica.



Deja un comentario