
EL ÁTOMO. EL NÚCLEO ATÓMICO
El interés que la humanidad ha demostrado a lo largo de su existencia para conocer la realidad que nos rodea, ha permitido un constante avance en el conocimiento de la estructura de la materia, desde Tales de Mileto (toda materia es, en último término, agua), pasado por la teoría de los cuatro elementos (agua, tierra, aire y fuego), hasta llegar a las actuales teorías sobre las partículas elementales y la cosmología.
Durante más de dos milenios han competido las ideas de Aristóteles, quien sostenía que la materia era continua (se podría proceder a dividir indefinidamente un cuerpo, en partes cada vez más pequeñas, sin que perdiera sus propiedades), con las de Leucipo y Demócrito, quienes suponían que todos los cuerpos estaban constituidos por un gran número de partículas a las que llamaron átomos (átomo = indivisible).
A principios del siglo XIX, John Dalton, partiendo de suponer que cada elemento está formado por átomos iguales entre sí, explicó que los compuestos son combinaciones de átomos de varios elementos, cuyas masas intervienen siempre en la misma proporción.
Siguiendo a Dalton, la mayoría de las sustancias tienen como unidad básica la molécula, la agrupación de unos pocos átomos. Las moléculas de un elemento están formadas por uno o varios átomos iguales, y las de un compuesto dado tienen siempre la misma proporción de átomos de sus elementos componentes.
No hubo, sin embargo, evidencia directa de la existencia de átomos y moléculas hasta que, en 1905, Albert Einstein interpretó el movimiento browniano (pequeñas partículas de polen suspendidas en agua se mueven incesantemente y de forma irregular) como el resultado del choque de las partículas con moléculas de agua no visibles ni con el más potente microscopio. Esta teoría daba una imagen conforme a la realidad y consideraba así probada experimentalmente la existencia de moléculas y, por extensión, la de átomos.
Modelos atómicos
A lo largo el siglo XIX va siendo universalmente aceptada la estructura atómica de la materia, y es aplicada al creciente número de elementos ya identificados. Se constatan ciertas periodicidades en las propiedades químicas y se intenta imaginar la estructura de los átomos.
El estudio de los rayos catódicos permitió, en 1894, a J. J. Thomson proponer un modelo formado por una esfera solida de una materia eléctricamente positiva en medio de la cuales estaban embutidos los electrones como las pasas en un pastel. Los rayos catódicos resultaron ser electrones arrancados del cátodo (el electrodo negativo) de un tubo de vacío, bien por el efecto de calentamiento o efecto termoiónico, bien por la acción de un campo eléctrico intenso. Otro modelo suponía una masa eléctricamente neutra con diversos pares de cargas de signos diferentes distribuidos en ella.
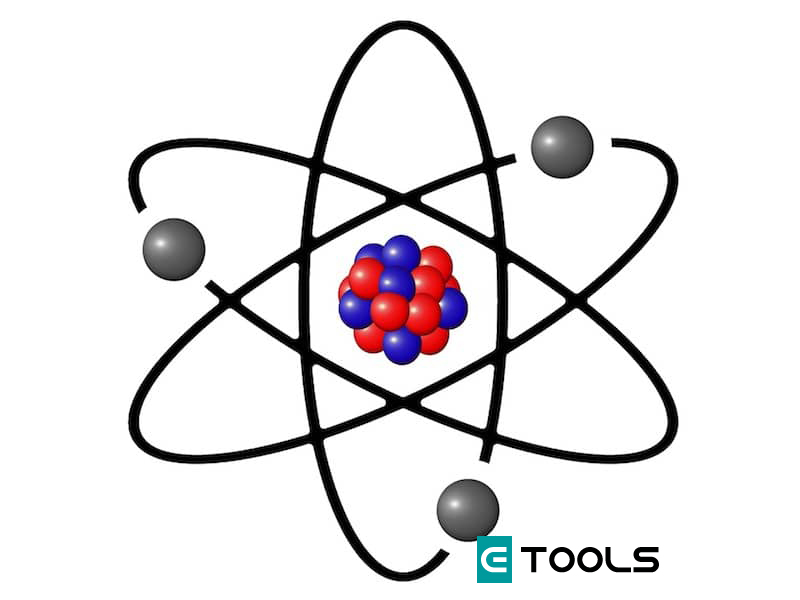
Modelo de Rutherford
En 1911, Ernest Rutherford propuso a sus colaboradores Geiger y Mardsen el estudio de la dispersión, por una fina lámina de oro (10-7m), de un haz de partículas α demitidas por una sustancia radiactiva.
El resultado fue que, aunque la mayoría no eran desviadas, algunas sufrían alguna dispersión; y unas pocas, una desviación muy acentuada. Por último, una pequeña proporción de partículas rebotaban en la lámina y eran repelidas. La experiencia se interpretó como una clara demostración de la existencia de una concentración de masa, cargada positivamente, en una región relativamente pequeña (10-12 veces el átomo) a la que se llamó núcleo. El modelo de Rutherford suponía también que los electrones orbitaban alrededor del núcleo como en un sistema planetario.
El núcleo
Como se había comprobado que el átomo emitía partículas α y β y radiaciones γ que debían de proceder del núcleo, fueron considerados éstos sus componentes. Sin embargo, con las partículas α y β no era posible construir ni el átomo de hidrógeno, el átomo más ligero. Cuando en 1919 Rutherford aisló su núcleo positivo, lo consideró un componente básico de todos los demás y lo llamó protón (el primero); y sugirió, además, la existencia de otro componente eléctricamente neutro y de masa similar, al que llamó neutrón, que fue finalmente identificado por James Chadwick en el año 1932.
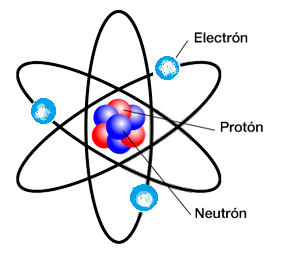
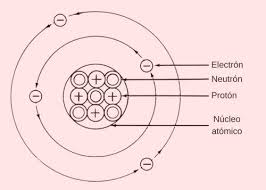
Con ello quedaba definida la estructura primaria del núcleo de un átomo cualquiera. El número de protones (Z) se denomina número atómico, que es el mismo para todos los átomos de un elemento químico. El número total de protones y neutrones es el número de masa (A), por lo general superior a 2Z, el cual no define a un elemento químico, puesto que átomos de un mismo elemento pueden contener distinto número de neutrones, en cuyo caso reciben el nombre de isótopos de dicho elemento. La mayoría de elementos químicos contiene una proporción prácticamente constante de sus diversos isótopos. Las propiedades químicas dependen exclusivamente del número de electrones y de su distribución en la corteza, y no varían para los distintos isotopos de un mismo elemento. Finalmente cabe señalar que el número de electrones en la corteza de un átomo coincide con el numero atómico Z y con el número de protones del núcleo, puesto que el átomo es eléctricamente neutro.
Una pregunta queda en el aire. Si el núcleo reúne varias cargas positivas en una pequeña región y sabemos que cargas del mismo signo son sometidas a mutuas repulsiones electroestáticas, ¿Cuál es la fuerza que las mantiene unidas? La energía de enlace entre las partículas del núcleo es debida a la interacción fuerte.
¡Si te gustó el artículo no dudes en dejarnos un comentario aquí abajo!
Si quieres conocer otros artículos parecidos a EL ÁTOMO. EL NÚCLEO ATÓMICO puedes visitar la categoría Fisica.





Deja un comentario